Diferença Entre 1s e 2s Orbital | 1s vs 2s Orbital
Diferença-chave - 1s vs 2s Orbital
O átomo é a menor unidade de matéria. Em outras palavras, toda a matéria é feita de átomos. Um átomo é composto de partículas subatômicas, principalmente, prótons, elétrons e nêutrons. Protons e elétrons fazem o núcleo, que está localizado no centro do átomo. Mas os elétrons são posicionados em orbitais (ou níveis de energia) que estão localizados fora do núcleo de um átomo. Também é importante notar que os orbitais são conceitos hipotéticos que são usados para explicar a localização mais provável de um átomo. Existem vários orbitais em torno do núcleo. Existem também sub-orbitais como s, p, d, f, etc. O sub-orbital s é de forma esférica quando considerado como uma estrutura em 3D. O orbital s tem a maior probabilidade de encontrar um elétron ao redor do núcleo. Um sub-orbital é novamente numerado como 1s, 2s, 3s, etc. de acordo com os níveis de energia. A principal diferença entre 1s e 2s orbital é a energia de cada orbital. 1 orbital tem uma energia menor do que a orbital 2s.
ÍNDICE
1. Visão geral e diferença de chave
2. O que é 1 Orbital
3. O que é 2s Orbital
4. Comparação lado a lado - 1s vs 2s Orbital
5. Resumo
O que é Orbital de 1? O orbital
1 é o orbital mais próximo do núcleo. Tem a menor energia entre outros orbitais. É também a menor forma esférica. Portanto, o raio do orbital s é pequeno. Pode haver apenas 2 elétrons no orbital s. A configuração eletrônica pode ser escrita como 1s 1 , se houver apenas um elétron no orbital s. Mas se houver um par de elétrons, ele pode ser escrito como 1s 2 . Então, os dois elétrons no orbital s se movem para as direções opostas por causa da repulsão que ocorre devido às mesmas cargas elétricas dos dois elétrons. Quando há um elétron não emparelhado, ele é chamado de paramagnético. Isso é porque pode ser atraído por um ímã. Mas se o orbital estiver cheio e um par de elétrons estiverem presentes, os elétrons não podem ser atraídos por um ímã; isso é conhecido como diamagnético.
O que é 2 orbital?
O orbitário 2s é maior do que o orbital de 1s. Portanto, seu raio é maior do que o orbital 1s. É o próximo orbital do armário ao núcleo após a orbital 1s. Sua energia é maior do que a orbital 1s, mas é menor que outras orbitais em um átomo. O orbital 2 também pode ser preenchido apenas com um ou dois elétrons. Mas o orbital 2s é preenchido com elétrons somente após a conclusão do orbital 1s.Isso é chamado de princípio de Aufbau, que indica a ordem do preenchimento de elétrons em suborbitões.
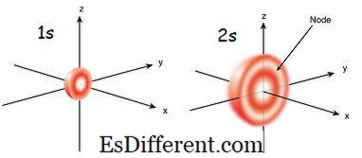
Figura 01: 1s e 2s Orbital
Qual a diferença entre 1s e 2s Orbital?
- diff Article Middle before Table ->
1s vs 2s Orbital |
|
| 1s orbital é o orbital mais próximo ao núcleo. | 2 orbital é o segundo orbital mais próximo ao núcleo. |
| Nível de energia | |
| A energia do orbital de 1 é maior que a da orbital 2s. | 2s tem energia comparativamente menor. |
| Raio de Orbital | |
| O raio da orbital de 1 é menor. | O raio do orbital 2s é comparativamente grande. |
| O tamanho do Orbital | |
| 1 orbital tem a menor forma esférica. | 2 orbital é maior do que o orbital 1s. |
| Enchimento de elétrons | |
| Os elétrons são primeiro preenchidos no orbital 1s. | 2s orbital é preenchido somente após a conclusão dos elétrons na orbital 1s. |
Resumo - 1s vs 2s Orbital
Um átomo é uma estrutura 3D contendo um núcleo no centro rodeado por orbitais de diferentes formas de diferentes níveis de energia. Esses orbitais são novamente divididos em sub-orbitais de acordo com pequenas diferenças de energia. Os elétrons, que é uma grande partícula subatômica de um átomo, estão localizados nesses níveis de energia. Os sub-orbitais 1s e 2s estão mais próximos do núcleo. A principal diferença entre os orbitais de 1s e 2s é a diferença de seu nível de energia, ou seja, o orbital de 2s é um nível de energia superior ao orbital de 1s.
Referência:
1. Libretextos. "Orbitais Atômicos". "Chemistry LibreTexts. Libretextos, 03 de novembro de 2015. Web. 26 de maio de 2017..
2. Átomos, elétrons e orbitais. N. p., n. d. Rede. 26 de maio de 2017..
Cortesia da imagem:
1. "Orbitais S" (recortados) pela Fundação CK-12 - Arquivo: Química do ensino médio. pdf, página 265 (CC BY-SA 3. 0) via Commons Wikimedia



