Diferença entre titulação de base de ácido e titulação de redox | Acide-Base Titração vs Redox Titration
Diferença-chave - Titulação Base Ácida vs. Redox Titulação
Em geral, As titulações são usadas para determinar a concentração de uma solução desconhecida (analito). Os dois métodos titulométricos mais utilizados são as titulações ácido-base e as titulações redox. A diferença-chave entre titulações ácido-base e titulações redox é a natureza da reação que ocorre entre o titulante e o analito na titulação. Nas titulações ácido-base, ocorre uma reação de neutralização e em titulações redox, ocorre uma reação de redox (uma reação oxidante e uma reação de redução). O uso de indicadores é o método mais utilizado para determinar o ponto final da reação.
O que é uma titulação de ácido-base?
Em titulações ácido-base, é utilizado como titulante um ácido (titulações ácidas) ou uma base (titulações básicas). Exemplos de ácidos utilizados em titulações ácidas são H 2 SO 4 , HCl ou HNO 3. Os titulantes básicos mais usados são NaOH, K 2 CO 3 ou Na 2 CO 3. As titulações de base ácida podem ser classificadas da seguinte forma, dependendo da força do ácido e da base.
- Ácido forte - titulações de base fortes
- Titulações de base forte e fraca
- Ácido fraco - titulações de base fortes
- Ácido fraco - titulações de base fracas
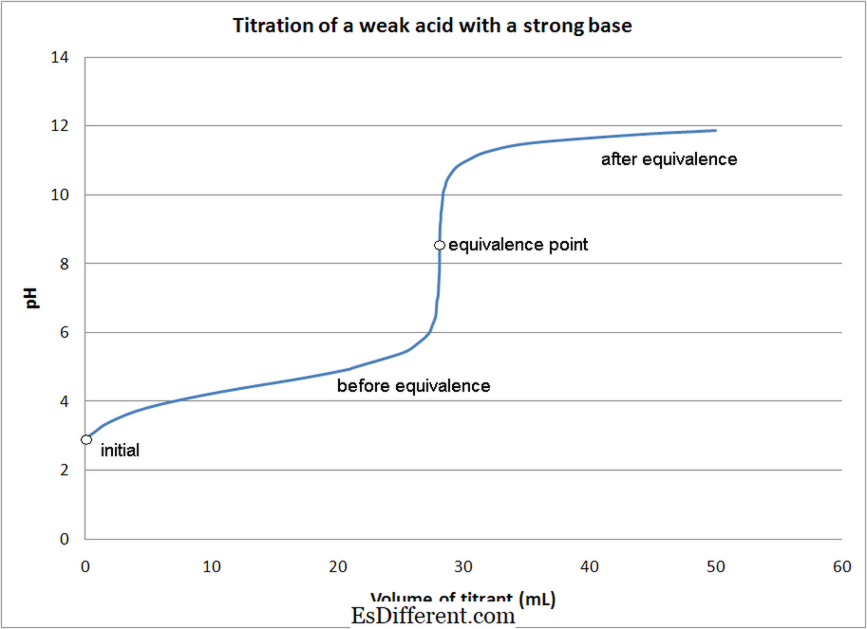
Na maior parte do ácido - titulações de base, indicadores são usados para determinar o ponto final da reação. Diferentes indicadores são usados de acordo com o tipo de titulação conforme mencionado acima.
O que é uma titulação Redox?
Uma titulação redox envolve uma reação redox. A reação Redox possui duas reações; uma reação de oxidação e uma reação de redução. Ambos os processos de oxidação e redução ocorrem ao mesmo tempo, o que nos permite determinar a conclusão da reação. Isso também é conhecido como o ponto final da titulação. Isso pode ser determinado de várias maneiras; usando eletrodos indicadores, indicadores redox (o indicador produz uma cor diferente no estado de redução de oxidação) e indicadores não redox (o indicador produz uma cor quando uma quantidade excessiva de titulante é adicionada).

Qual a diferença entre Titulação Ácida-Base e Redação de Redox?
Natureza da reação:
Titulação Base Ácida: Uma titulação ácido-base envolve uma reação de neutralização entre o analito (a solução com a concentração desconhecida) e o titulante ácido ou básico.
Redox Titration: Uma reação redox envolve uma reação de oxidação e redução entre o analito e o titulante. Não existe tal regra que o componente oxida e qual o reduzido. O analito ou o titulante se oxida e o componente restante se reduz de acordo.
Determinação do ponto final:
Titulação ácida-base: Em geral, um indicador de pH, um medidor de pH ou um medidor de condutância é usado para determinar o ponto final de uma titulação ácido-base.
Redox Titration: Os métodos mais comumente usados para determinar o ponto final de uma reação redox estão usando um potenciômetro ou um indicador redox. Mas, com mais freqüência, o analito ou o titulante produz uma cor no ponto final. Para isso, não são necessários indicadores adicionais nesses casos.
Exemplos:
Titulação Ácida-Base:
- diff Artigo Médio antes da Tabela ->| Tipo | Reação (Indicador) |
| Ácido forte - titulação de base forte | HCl + NaOHàNaCl + H 2 O (Fenolftaleína / Metil laranja) |
| Ácido forte - titulação de base fraca | HCl + NH 3 à NH 3 Cl (Laranja de metilo) |
| Ácido fraco - titulação de base forte | CH 3 COOH + NaOHà CH 3 COONa + H 2 O (Fenolftaleína) |
| Titulação de base fraca fraca | CH 3 COOH + NH 3 àCH 3 COO - + NH 4 + (Sem indicadores adequados) |
Redox Titration:
2 KMnO 4 + 5 H 2 C 2 O 4 + 6 HCl → 2 MnCl 2 + 2KCl + 10 CO 2 + 8 H 2 O (+ 7) (+3) (+2) (+ 4)
Na reação acima, o permanganato é reduzido enquanto o ácido oxálico é oxidado. Quando a reação se completa, a cor roxa do permanganato se transforma em incolor.
KMnO
4 + 5FeCl 2 + 8HCl 5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2)
Cortesia da imagem:
1. Titulação de ácido fraco com base forte Por Quantumkinetics (Trabalho próprio) [CC BY 3. 0], via Wikimedia Commons
2. "Titulação prévia de titulação de Winkler" por Willwood [CC BY-SA 3. 0] via Commons