Diferença entre Alkanes e Alkene | Alkanes vs Alkene
Diferença-chave - Alkanes vs Alkenes
Alkanes e Alkenes são dois tipos de famílias de hidrocarbonetos que contêm carbono e hidrogênio em sua estrutura molecular. A principal diferença entre Alkanes e Alkenes é a sua estrutura química; alcanos são hidrocarbonetos saturados com a fórmula molecular geral de C n H 2n + 2 e os alcenos são considerados um grupo hidrocarboneto insaturado, uma vez que contêm uma ligação dupla entre dois átomos de carbono átomos. Eles têm a fórmula molecular geral de C n H 2n.
O que são Alkanes?
Os alcanos contêm apenas ligações simples entre átomos de carbono e hidrogênio (ligações C-C e ligações C-H). Portanto, eles são chamados de "hidrocarbonetos saturados". De acordo com o modelo de hibridação orbital, todos os átomos de carbono em Alkenes têm a hibridização SP 3 . Eles formam sigma com átomos de hidrogênio e a molécula resultante possui a geometria de um tetraedro. Os alcanes podem ser subdivididos em dois grupos de acordo com seus arranjos moleculares; alcanos acíclicos (C n H 2n. +2 ) e alcanos cíclicos (C n H 2n ).

O que são Alkenes?
Os alcanos são os hidrocarbonetos, contendo uma ligação dupla carbono-carbono (C = C). "Olefinas" é o nome antigo usado para se referir à família de alcenos. O menor membro desta família é o etano (C 2 H 4 ); chamou-se olefian t gas (Em latim: < oleum ' significa' óleo '+ ' facere ' significa' fazer ') nos primeiros dias. Isso ocorre porque a reação entre C 2 H 4 e Cloro dá C 2 H 2 Cl 2 , óleo.

Qual a diferença entre Alkanes e Alkenes?
Estrutura Química de Alkanes e Alkenes
Alkanes: Os alcanos têm a fórmula molecular geral C n H 2n + 2. O metano (CH 4 ) é o alcano mais pequeno.
- diff Artigo Médio antes da Tabela ->| Nome | Fórmula química | Estrutura acíclica |
| Metano | CH 4 | CH 4 |
| Etano C | 2 H 6 CH | 3 CH 3 Propano |
| C | 3 H 8 CH | 3 CH 2 CH 3 Butano |
| C | 4 H 10 CH 3 | CH 2 CH 2 CH 3 Pentano C |
| 5 | H 12 CH 3 | CH 2 CH 2 CH 2 CH 3 Hexano C |
| 6 H | 14 CH 3 CH | 2 CH 2 CH 2 CH 2 CH 3 Heptano C 7 |
| H | 16 CH 3 CH | 2 CH 2 CH 2 CH 2 CH 2 CH 3 Octano C 8 H |
| 18 | CH 3 CH 3 | CH 2 CH 2 CH 2 CH 2 CH 3 CH 3 Alkenos: Os alcanos têm a fórmula química geral de C n H 2n |
.Os alcanos são considerados hidrocarbonetos não saturados, uma vez que não contêm o número máximo de átomos de hidrogênio que podem ser de propriedade de uma molécula de hidrocarboneto. Nome Fórmula química Estrutura Ethene C
| 2 | H | 4 |
| CH | 2 = CH 2 Propene | C 3 H 6 |
| CH | 3 CH = CH 2 Buteno | C 4 H 8 |
| CH | 2 = CHCH 2 CH | 3, CH 3 CH = CHCH 3 Pentene C 5 H 10 CH |
| 2 = | CHCH 2 CH 2 | CH 3 CH 3 CH = CHCH 2 CH 3 Hexeno C 6 H 12 CH 2 = |
| CHCH | 2 CH 2 CH | 2 CH 3 CH 3 CH = CHCH 2 CH 2 CH 3 CH 3 CH 2 CH = CHCH
2 CH 3 Heptene C 7 H 14 CH = |
| CHCH < 2 | CH 2 CH 2 | CH 2 CH 3 CH 3 CH = CH < 2 CH 2 CH 2 CH 2 CH 3 Propriedades químicas de alcanos e alcanos Alcanês: Reatividade: Os alcanos são inertes para muitos reagentes químicos. Isso ocorre porque as ligações Carbono-carbono (C-C) e Carbono-Hidrogênio (C-H) são bastante fortes, pois os átomos de carbono e hidrogênio têm quase os mesmos valores de eletricidade. Portanto, é muito difícil quebrar seus vínculos, a menos que sejam aquecidos a temperaturas bastante elevadas. Combustão: Os alcanos podem facilmente queimar no ar. A reação entre Alkanes com excesso de oxigênio é chamada de "combustão". Nesta reacção, os alcanos convertem-se em dióxido de carbono (CO 2 ) e água. C |
n
H 2n
+ (n + n / 2) O
2
→ CO
2 + nH 2
O C 4 H 10 + 13/2 O 2 → 4 CO 2 + 5H 2 O
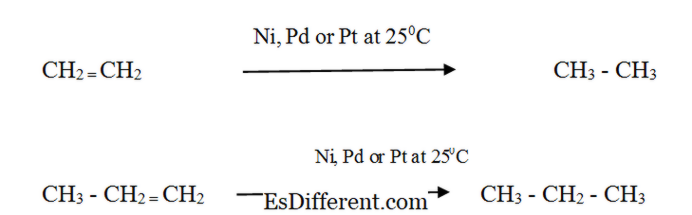
Água de dióxido de carbono com oxigénio de butano As reações de combustão são reações exotérmicas (liberam calor). Como resultado, os alcanos são usados como fonte de energia. Alkenes: Reatividade: Os alquenos reagem com hidrogênio na presença de um catalisador de metal finamente dividido para formar o alcano correspondente. A taxa da reação é muito baixa sem um catalisador. A hidrogenação catalítica é utilizada na indústria de alimentos para converter óleos vegetais líquidos em gordura semi-sólida na fabricação de margarina e gordura de cozimento sólida. Propriedades físicas de Alkanes e Alkenes Formulários Alcanês: Alcanês existem como gases, líquidos e sólidos. O metano, o etano, o propano e o butano são gases à temperatura ambiente. As estruturas não ramificadas de hexano, pentano e heptano são líquidos. Os alcanos que têm um peso molecular mais elevado são sólidos. CH
4
a C
4
H
10
são gases
C
5
H 12
para C 17 H 36 são líquidos e Alcanês com maior peso molecular são sólidos macios Alkenes:
Os alkenos apresentam propriedades físicas semelhantes do Alkane correspondente. Os alcenóis que têm pesos moleculares mais baixos (C 2 H 4 a 4 H 8 ) são gases à temperatura ambiente e pressão atmosférica.Os álkenos com maior peso molecular são sólidos.
Solubilidade:
Alcanês: Os alcanos não se dissolvem na água. Eles são dissolvidos em solventes orgânicos não-polares ou fracamente polares. Alkenes: Os alquenos são moléculas relativamente polares devido à ligação C = C; portanto, são solúveis em solventes não-polares ou solventes de baixa polaridade. A água é uma molécula polar e os alcenos são ligeiramente solúveis em água. Densidade: Alcanês: As densidades de Alkanes são inferiores à densidade da água. Seu valor de densidade é quase 0. 7 g mL -1 , considerando a densidade de água como 1. 0 g mL -1
.
Alkenes: As densidades de Alkenes são inferiores à densidade da água.
Pontos de ebulição: Alcanês:
O ponto de ebulição dos alcanos não ramificados aumenta suavemente à medida que o número de átomos de carbono e o peso molecular estão aumentando. Em geral, os alcanos ramificados têm pontos de ebulição mais baixos em comparação com os alcanos não ramificados, com o mesmo número de átomos de carbono.
Alkenes : Os pontos de ebulição são semelhantes aos alcanos correspondentes com uma pequena variação. Referências: CliffsNotes. (n. d.). Retirado em 06 de julho de 2016, a partir daqui. Propriedades físicas dos alcanos. (2013). Retirado 06 de julho de 2016, a partir daqui Zum Directory-modus. (n. d.). Retirado 06 de julho de 2016, a partir daqui
Propriedades químicas dos Alkanes: Wizznotes. Conforme GCSE e CXC: Tutoriais, Documentos passados e Testes. (n. d.). Retirado 06 de julho de 2016, daqui Polaridade. (n. d.). Retirado 06 de julho de 2016, daqui
momentos de dipolo. (2013). Recuperado em 06 de julho de 2016, a partir daqui
Isômero estrutural. (n. d.). Retirado em 06 de julho de 2016, a partir daqui Uma introdução aos alquenos. (n. d.). Retirado 06 de julho de 2016, a partir daqui
Cortesia da imagem: "Nomes de Alkene" Por Chris Evans - (CC0) via Commons Wikimedia
"Bicicletas e álbuns de carbono saturado C4" Por Fvasconcellos - Trabalho próprio (Public Domain) via Commons Wikimedia



