Diferença entre Alpha Helix e Beta plissada | Alpha Helix e Beta Plissado
Diferença-chave - Hélice Alpha versus Folha plástica beta
As hélices alfa e as folhas plissadas beta são as duas estruturas secundárias mais comumente encontradas em uma cadeia de polipéptidos. Estes dois componentes estruturais são os primeiros passos principais no processo de dobragem de uma cadeia polipeptídica. A diferença de chave entre Alpha Helix e Beta Plissada está em sua estrutura ; Eles têm duas formas diferentes para fazer um trabalho específico.
O que é Alpha Helix?
Uma hélice alfa é uma bobina direta de resíduos de aminoácidos em uma cadeia de polipéptido. A gama de resíduos de aminoácidos pode variar de 4 a 40 resíduos. As ligações de hidrogênio formadas entre o oxigênio do grupo C = O na bobina superior e o hidrogênio do grupo N-H da bobina inferior ajudam a manter a bobina em conjunto. É formada uma ligação de hidrogénio por cada quatro resíduos de aminoácidos na cadeia da maneira acima. Este padrão uniforme dá características definidas, como a espessura da bobina e determina o comprimento de cada volta completa ao longo do eixo da hélice. A estabilidade da estrutura de alfa-hélice depende de vários fatores.

átomos de O em vermelho, átomos de N em azul e ligações de hidrogênio como linhas pontilhadas verdes
O que é a folha plissada beta?
A folha beta plissada, também conhecida como folha beta, é considerada como a segunda forma de estrutura secundária em proteínas. Ele contém fios beta que estão conectados lateralmente por um mínimo de duas ou três ligações de hidrogênio do backbone para formar uma folha repleta e plissada como mostrado na figura. Uma cadeia beta é um estiramento da cadeia polipeptídica; o seu comprimento é geralmente igual a 3 a 10 aminoácidos, incluindo o backbone em uma confirmação prolongada.
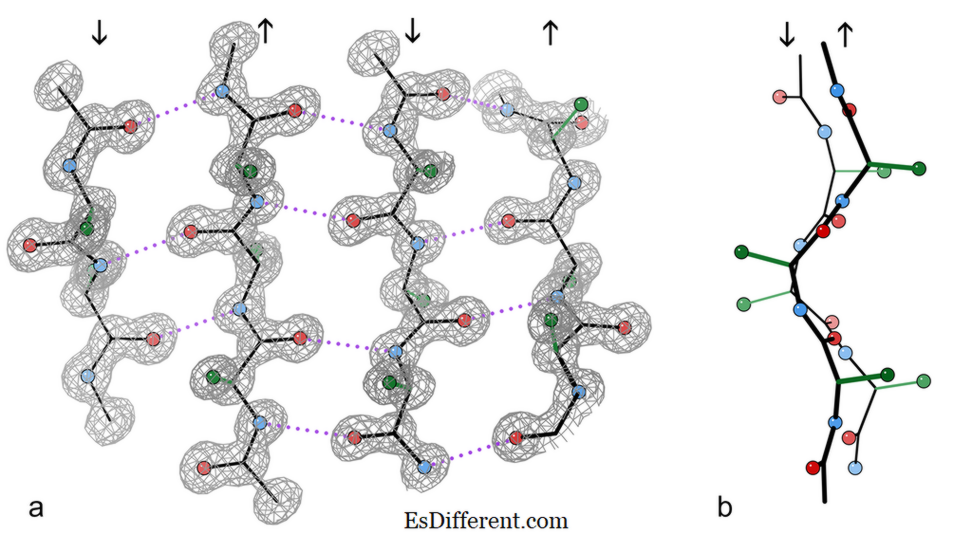
fragmento de folha beta antiparalhado de 4 cadeias a partir de uma estrutura cristalina da enzima catalase.
a) mostrando as ligações de hidrogênio antiparalelas (pontilhadas) entre os grupos peptídico NH e CO em cadeias adjacentes. As setas indicam a direção da corrente e os contornos da densidade eletrônica descrevem os átomos não-H. Os átomos de O são bolas vermelhas, os átomos de N são azuis e os átomos de H são omitidos por simplicidade; As cadeias laterais são mostradas apenas para o primeiro átomo C da região lateral (verde)
b) Visão frontal das duas cadeias β
Em folhas plissadas beta, as cadeias polipeptídicas correm uma ao lado da outra. Obtém o nome de "folha plissada" devido à aparência ondulada da estrutura. Eles estão ligados entre si por ligações de hidrogênio.Esta estrutura permite formar mais ligações de hidrogênio esticando a cadeia polipeptídica.
Qual a diferença entre Alpha Helix e Beta Plissada?
Estrutura da Hélice Alfa e Placa Beta Plissada
Alfa Helix:
Nesta estrutura, o esqueleto do polipéptido está fortemente ligado em torno de um eixo imaginário como uma estrutura em espiral. É também conhecido como o arranjo helicoidal da cadeia peptídica.
A formação da estrutura da hélice alfa ocorre quando as cadeias polipeptídicas são torcidas em uma espiral. Isso permite que todos os aminoácidos na cadeia formem ligações de hidrogênio (uma ligação entre uma molécula de oxigênio e uma molécula de hidrogênio) entre si. As ligações de hidrogênio permitem que a hélice segure a forma espiral e dê uma bobina apertada. Esta forma espiral faz a hélice alfa muito forte.
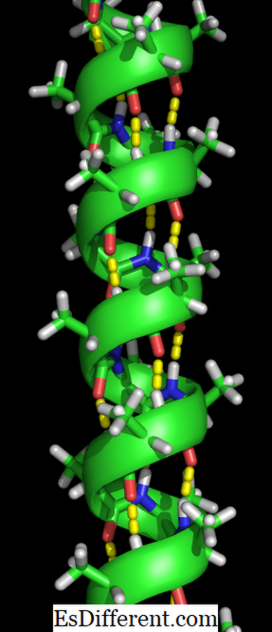
As ligações de hidrogênio são indicadas pelos pontos amarelos.
Folha beta plissada:
Quando dois ou mais fragmentos de cadeia (s) de polipéptido se sobrepõem um com o outro, formando uma linha de ligações de hidrogênio entre si, podendo encontrar estruturas. Pode acontecer de duas maneiras; arranjo paralelo e arranjo anti-paralelo.
Exemplos da estrutura:
Alpha Helix: As unhas ou unhas dos pés podem ser tomadas como um exemplo de uma estrutura de alfa-hélice.
Folha plissada beta: A estrutura das penas é semelhante à estrutura da folha plissada beta.
Características da estrutura:
Alpha Helix: Na estrutura de alfa-hélice, existem 3. 6 aminoácidos por volta da hélice. Todas as ligações peptídicas são trans e planar, e os grupos N-H nas ligações peptídicas apontam na mesma direção, que é aproximadamente paralelo ao eixo da hélice. Os grupos C = O de todas as ligações peptídicas apontam na direção oposta e são paralelos ao eixo da hélice. O grupo C = O de cada ligação peptídica é ligado ao grupo N-H da ligação peptídica formando uma ligação de hidrogénio. Todos os grupos R são apontados para fora da hélice.
Folha beta plissada: Cada ligação peptídica na folha plissada beta é planar e tem a transconformação. Os grupos C = O e N-H de ligações peptídicas de cadeias adjacentes estão no mesmo plano e apontam um para o outro formando ligação de hidrogénio entre eles. Todos os grupos R em qualquer cadeia podem alternativamente ocorrer acima e abaixo do plano da folha.
Definições:
Estrutura secundária: é a forma de uma proteína dobrável devido à ligação de hidrogênio entre seus grupos de amida e carbonilo da espinha dorsal.
Referências: "Estrutura proteica". ChemWiki: The Dynamic Chemistry Hypertext "Proteína Estrutura secundária: α-Helices e β-Sheets". Proteínas. com por Salam Al Karadaghi "Química Orgânica". O livro de texto da célula virtual "Beta Sheet". Wikipedia Image Cortesia: "Helix electron density myoglobin 2nrl 17-32" Por Dcrjsr - Trabalho próprio (CC BY 3. 0) via Commons Wikimedia "Protein secondary structure" por en: Usuário: Bikadi (CC BY-SA 3. 0) via Commons Wikimedia "1gwe antipar beta Folhear ambos" por Dcrjsr - Trabalho próprio (CC BY 3.0) via Commons Wikimedia



