Diferença entre nitrato de amónio e ureia
Nitrato de amónio versus ureia
Os compostos que contêm nitrogênio são comumente usados como fertilizantes porque o nitrogênio é um dos elementos altamente essenciais para crescimento e desenvolvimento de plantas. O nitrato de amônio e a ureia são sólidos contendo nitrogênio.
Nitrato de amónio
O nitrato de amónio tem a fórmula química de NH 4 NO 3 . Este é o nitrato de amônia, e tem a seguinte estrutura.

À temperatura ambiente e a pressão padrão, o nitrato de amônio existe como um sólido cristalino branco inodoro. Este é um sal ácido com um pH de cerca de 5. 4. Sua massa molar é de 80. 052 g / mol. O ponto de fusão do nitrato de amónio é de cerca de 170 ° C e ele se decompõe quando aquecido a cerca de 210 o C. O nitrato de amônio é usado principalmente para fins agrícolas. É rico em nitrogênio, por isso é usado como fertilizante, para fornecer nitrogênio a plantas. Como seu contato direto com produtos químicos não é perigoso e sua toxicidade é menor, é benéfico usar como fertilizante. Além disso, o aquecimento ou a ignição fazem com que o nitrato de amônio explodisse. Portanto, é usado como agente oxidante em explosivos. Devido a essa natureza explosiva, ao armazenar nitrato de amônio, devemos ser extremamente cuidadosos. O nitrato de amônio é estável, mas quando está no estado fundido, o risco de explosão é maior. O risco aumenta se entrar em contato com materiais oxidáveis, como óleo, diesel, papel, pano ou palha. A produção de nitrato de amônio é uma simples reação química. Quando o ácido nítrico é reagido com amoníaco líquido, o nitrato de amônio na forma da solução é produzido. Industrialmente, o ácido nítrico concentrado e o gás amônia são utilizados para a produção. Uma vez que esta é uma reação altamente exotérmica e violenta, é desafiador produzi-la em grande escala. Sendo um sal, o nitrato de amônio é altamente solúvel em água. Portanto, quando é usado como fertilizante pode ser lavado e acumulado em corpos d'água. Esta poderia ser uma condição fatal para a vida aquática.
Ureia
A ureia tem a fórmula molecular de CO (NH 2 ) 2 e a seguinte estrutura.
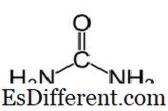
É uma carbamida com o grupo funcional C = O. Dois grupos NH 2 estão ligados ao carbono carbonílico de dois lados. A ureia é naturalmente produzida em mamíferos no metabolismo do nitrogênio. Isso é conhecido como o ciclo da ureia, e a oxidação da amônia ou aminoácidos produz uréia dentro de nossos corpos. A maior parte da ureia é excretada através de rins com urina, enquanto algumas são excretadas com suor. A alta solubilidade em água da ureia é útil quando a excreta do corpo. A ureia é um sólido incolor e inodoro, e não é tóxico. Além de ser um produto metabólico, seu uso principal é produzir fertilizantes.A ureia é um dos adubos que liberam nitrogênio mais comum, e possui alto teor de nitrogênio em comparação com outros fertilizantes nitrogenados sólidos. No solo, a ureia é convertida em amônia e dióxido de carbono. Esta amônia pode ser convertida em nitrito por bactérias do solo. Além disso, a ureia é usada para produzir explosivos como o nitrato de uréia. É usado também como matéria-prima para produzir produtos químicos como plásticos e adesivos.
|
Qual a diferença entre Nitrato de amónio e ureia ? • A fórmula molecular do nitrato de amónio é NH 4 NO 3. A fórmula molecular da ureia é CO (NH 2 ) 2. • O nitrato de amônio é um sal, enquanto que a ureia não é. É uma carbamida (molécula orgânica). • Quando dissolvido em água, o nitrato de amônio produz uma solução ácida. Em contraste, as soluções de ureia não são nem ácidas nem alcalinas. |




