Diferença Entre EDTA e EGTA
EDTA vs EGTA
EDTA e EGTA são ambos agentes quelantes. Ambos são ácidos poliamina carboxílicos e têm mais ou menos as mesmas propriedades.
EDTA
EDTA é o nome abreviado para o ácido etileno diamina tetraacetico. É também conhecido como ácido (etilenoditrilo) tetraacetico. A seguir está a estrutura do EDTA.
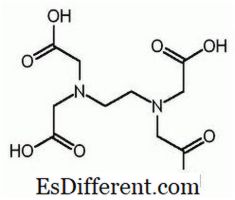
A molécula de EDTA possui seis locais onde um ião metálico pode ser encadernado. Existem dois grupos amino e quatro grupos carboxilo. Os dois átomos de nitrogênio dos grupos amino possuem um par de elétrons não compartilhados em cada um. EDTA é um ligando hexadentado. Além disso, é um agente quelante devido à capacidade de seqüestro de iões metálicos. EDTA forma quelatos com todos os catiões, com excepção dos metais alcalinos e estes quelatos são suficientemente estáveis. A estabilidade resulta dos vários sítios complexantes dentro da molécula que dão origem a uma estrutura em forma de gaiola que envolve o íon metálico. Isso isola o íon metálico das moléculas solventes, evitando assim a solvatação. O grupo carboxilo do EDTA pode dissociar os protões de doação; portanto, EDTA possui propriedades ácidas. As várias espécies de EDTA são abreviadas como H 4 Y, H 3 Y - , H 2 Y 2-, HY3 - e Y 4- . A um pH muito baixo (meio ácido), a forma protonada de EDTA (H 4 Y) é predominante. Em contraste, a pH elevado (meio básico), a forma totalmente desprotonada (Y 4-) predomina. E à medida que o pH muda de pH baixo para pH elevado, predominam outras formas de EDTA em certos valores de pH. EDTA está disponível como forma totalmente protonada ou qualquer outra forma de sal. EDTA dissódico e EDTA dissódico de cálcio são as formas de sal mais comuns disponíveis. O ácido livre H 4 Y e o di-hidrato do sal de sódio 2 H 2 Y. 2H 2 O estão comercialmente disponíveis em qualidade de reagente.
EGTA
EGTA é o termo abreviado para o ácido tetracetico de etilenoglicol. É um agente quelante, e muito semelhante ao EDTA.EGTA tem uma maior afinidade pelos íons de cálcio do que os íons de magnésio. EGTA possui a seguinte estrutura.Similar ao EDTA, EGTA também tem quatro grupos carboxilo, que podem produzir quatro prótons após a dissociação. Existem dois grupos de amina e os dois átomos de nitrogênio dos grupos amino têm pares de elétrons não comparados em cada um. EGTA pode ser usado como um buffer para se assemelhar ao pH de uma célula viva. Esta propriedade da EGTA permite o seu uso na purificação por afinidade em Tandem, que é uma técnica de purificação de proteínas.
Qual a diferença entre

EDTA e EGTA




