Diferença entre compostos iónicos e covalentes | Ionic vs Covalent Compounds
Diferença-chave - Compostos iónicos vs covalentes
Muitas diferenças podem ser observadas entre compostos iónicos e covalentes com base nas suas propriedades macroscópicas, como a solubilidade em água, condutividade elétrica, pontos de fusão e pontos de ebulição. O principal motivo para essas diferenças é a diferença em seu padrão de ligação. Portanto, seu padrão de ligação pode ser considerado como a diferença de chave entre compostos iónicos e covalentes. (Diferença entre as ligações iónicas e covalentes) Quando as ligações iónicas são formadas, os elétrons são doados por um metal e o (s) elétron (s) doado é aceito por um não-metal. Eles formam um forte vínculo devido à atração eletrostática. As ligações covalentes são formadas entre dois não-metais. Na ligação covalente, dois ou mais átomos compartilham elétrons para satisfazer a regra do octeto. Geralmente, as ligações iónicas são mais fortes do que as ligações covalentes. Isso leva a diferenças em suas propriedades físicas.
O que são compostos iónicos?
As ligações iónicas são formadas quando dois átomos têm uma grande diferença em seus valores de electronegatividade. No processo de formação de vínculo, os elétrons (s) menos eletronegativos de átomos de átomos e o átomo mais eletronegativo ganham esses elétrons. Portanto, as espécies resultantes são íons carregados de forma oposta e formam uma ligação devido à forte atração eletrostática.
As ligações iónicas são formadas entre metais e não metais. Em geral, os metais não possuem muitos elétrons de valência na camada mais externa; no entanto, os não-metais têm mais perto de oito elétrons na casca de valência. Portanto, os não-metais tendem a aceitar elétrons para satisfazer a regra do octeto.
Exemplo de composto iónico é Na + + Cl - à NaCl
O sódio (metal) tem apenas um elétron de valência e o cloro (não metálico) tem sete elétrons de valência.

O que são compostos covalentes?
Os compostos covalentes são formados compartilhando elétrons entre dois ou mais átomos para satisfazer a "regra de octeto". Este tipo de ligação é comumente encontrado em compostos não metálicos, átomos do mesmo composto ou elementos próximos na tabela periódica. Dois átomos que têm quase os mesmos valores de eletronegatividade não trocam (doam / recebem) elétrons de sua concha de valência. Em vez disso, eles compartilham elétrons para alcançar a configuração do octeto.
Exemplos de compostos covalentes são Metano (CH 4 ), Monóxido de carbono (CO), monobrometo de iodo (IBr)
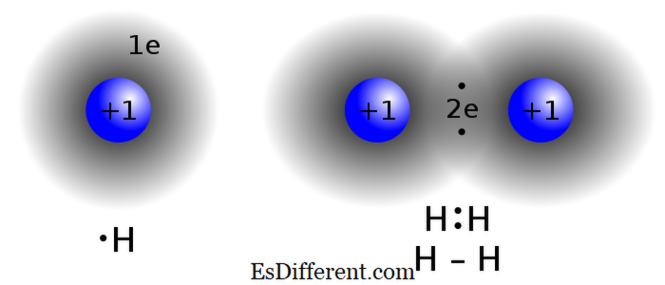
Ligação covalente
Qual a diferença entre Iónico e Covalente Compostos?
Definição de compostos iónicos e compostos covalentes
Composto iónico: O composto iónico é um composto químico de catiões e aniões que são mantidos em conjunto por ligações iônicas em uma estrutura em rede.
Composto covalente: O composto covalente é uma ligação química formada pelo compartilhamento de um ou mais elétrons, especialmente pares de elétrons, entre átomos.
Propriedades de compostos iónicos e covalentes
Propriedades físicas
Compostos iónicos:
Todos os compostos iónicos existem como sólidos à temperatura ambiente.
Os compostos iónicos possuem uma estrutura de cristal estável. Portanto, eles têm pontos de fusão e pontos de ebulição mais altos. As forças de atração entre íons positivos e negativos são muito fortes.
- diff Artigo Médio antes da Tabela ->| Composto iónico | Aparência | Ponto de fusão |
| NaCl - Cloreto de sódio | Sólido cristalino branco | 801 ° C |
| KCl - Cloreto de potássio | Cristal vítreo branco ou incolor | 770 ° C |
| MgCl 2 - cloreto de magnésio | sólido cristalino branco ou incolor | 1412 ° C |
compostos covalentes: Os compostos covalentes existem nas três formas; como sólidos, líquidos e gases à temperatura ambiente.
Seus pontos de fusão e ebulição são relativamente baixos em comparação com os compostos iónicos.
Composto Covalente
| Aparência | Ponto de fusão | HCl-cloreto de hidrogênio |
| Um gás incolor | -114. 2 ° C | CH |
| 4 -Metano Um gás incolor | -182 ° C | CCl |
| 4 - tetracloreto de carbono Um líquido incolor < -23 ° C | Condutividade | Compostos iónicos: |
Os compostos iônicos sólidos não possuem elétrons livres; portanto, eles não conduzem eletricidade em forma sólida. Mas, quando os compostos iónicos são dissolvidos em água, eles fazem uma solução que conduz a eletricidade. Em outras palavras, soluções aquosas de compostos iónicos são bons condutores elétricos.
Compostos covalentes: Nem compostos covalentes puros nem formas dissolvidas na água não conduzem eletricidade. Portanto, os compostos covalentes são maus condutores elétricos em todas as fases.
Solubilidade Compostos iónicos:
A maioria dos compostos iónicos são solúveis em água, mas são insolúveis em solventes não-polares.
Compostos covalentes: A maioria dos compostos covalentes são solúveis em solventes não polares, mas não em água.
Dureza Compostos iónicos:
Os sólidos iónicos são compostos mais duros e quebradiços.
Compostos covalentes: Geralmente, os compostos covalentes são mais suaves do que os sólidos iônicos.
Imagem Cortesia: "Covalent bond hydrogen" de Jacek FH - Trabalho próprio. (CC BY-SA 3. 0) via Commons "IonicBondingRH11" de Rhannosh - Trabalho próprio. (CC BY-SA 3. 0) via Wikimedia Commons




