Diferença entre Monatomic e Diatomic | Monatomic vs Diatomic
A diferença entre monatômico e diatômico é principalmente em relação aos átomos presentes nas espécies. Como os nomes sugerem, ambos os termos representam diferentes estados de associações atômicas onde 'mono' significa 'um' e 'di' significa 'dois'. "Portanto, simplesmente, monatômico significa um '
um átomo ' e meios diatômicos ' dois átomos. ' No entanto, pode haver tantas variações diferentes para esta definição básica.
O que é monatômico?Quando
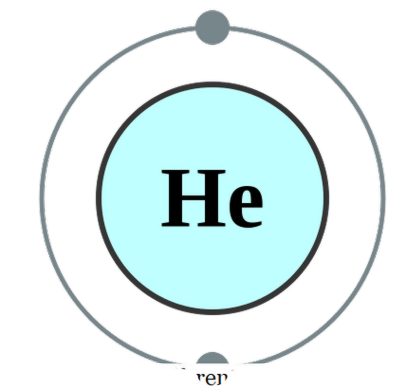
um único átomo existe por conta própria (o que raramente é o caso), chamamos isso de monatômico. Isso significa que os elementos estão em sua forma singular e pura. O único exemplo prático que pode pertencer a esta categoria seria os gases nobres que existem como átomos por conta própria, pois eles têm sua camada externa completa com um octeto de elétrons. Portanto, eles não olham para aceitar ou doar mais elétrons para serem mais estáveis. Portanto, os gases nobres são estáveis em forma monatômica. Alguns exemplos são; Ele - Helium, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
O que é Diatomic?
Quando
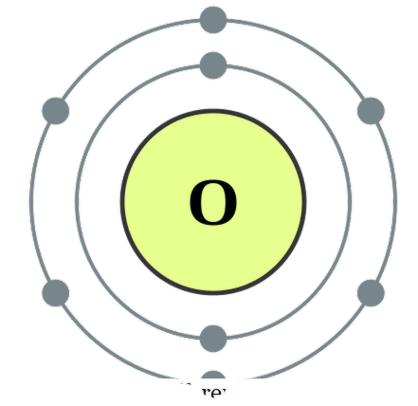
dois átomos estão associados um ao outro , chamamos isso de diatômico. Estes átomos podem ser do mesmo tipo ou diferentes. Quando eles são dois átomos semelhantes em associação, chamamos de diatomos homonucleares 'e se eles são feitos de diferentes tipos, chamamos de diatens heteronucleares '. Exemplos para algumas diatomeas homonucleares seriam O2, N2, H2, etc., enquanto o CO, NO, HCl, etc. podem ser dados como exemplos para diatomáceas heteronucleares. Oxigênio
As diatomáceas podem ser consideradas como compostos à medida que formam essas associações, a fim de obter mais estabilidade, compartilhando elétrons uns com os outros, de modo que ambos os átomos atinjam a configuração eletrônica de gás nobre. Eles podem se unir através de ligações covalentes pela sobreposição de orbitais atômicos ou então eles podem formar ligações iónicas entre eles, o que é uma força de atração entre uma espécie carregada positivamente e uma espécie carregada negativamente. Exemplos de ligações covalentes entre diatomos incluem CO, NO, etc. e HCl pode ser considerado como uma espécie com caráter de atração iónica. No entanto, como a força de atração entre H + e Cl- não é muito forte, não é um exemplo muito bom para ligações iónicas que é outro tópico definido.
Qual a diferença entre Monatomic e Diatomic?
• As espécies monatomicas possuem um átomo, enquanto que as espécies diatômicas possuem dois átomos.
• As espécies monatômicas geralmente não são estáveis, mas as espécies diatômicas geralmente são estáveis.
• Os gases nobres são apenas monatômicos e não são encontrados em forma diatômica.
• Existem ligações químicas entre espécies diatômicas, enquanto que não existem ligações em espécies monatômicas.
Imagens Cortesia:
Configuração de elétrons de hélio por Pumbaa (CC BY-SA 2. 0 uk)
- Configuração de elétrons de oxigênio por DePiep (CC BY-SA 3. 0)




