Diferença entre equação equilibrada e equação iónica líquida | Equação equilibrada vs equação iónica líquida
Diferença-chave - Equação equilibrada vs Equação iónica líquida
Todas as reações químicas podem ser escritas como uma equação. Os componentes desta equação incluem reagentes com seus estados físicos, uma seta para mostrar a direção da reação e os produtos de reação com seus estados físicos. Se houver alguma condição especial usada, elas também são escritas brevemente na seta. Se a reação estiver em equilíbrio, duas meias setas são usadas em direções opostas. Uma equação química pode ser escrita de duas maneiras: como equação equilibrada ou como uma equação iónica líquida. A principal diferença entre equação equilibrada e equação iónica líquida é que a equação equilibrada mostra todas as reações ocorridas em um sistema em conjunto enquanto que a equação iónica líquida apenas mostra a reação líquida que ocorreu após a conclusão desse particular reação.
ÍNDICE
1. Visão geral e diferença de chave
2. O que é uma equação equilibrada
3. O que é uma equação iónica líquida
4. Comparação lado a lado - equação equilibrada vs equação iónica líquida
5. Resumo
O que é uma equação equilibrada?
As reações químicas são muito importantes na compreensão do comportamento de um determinado sistema. Ao escrever a equação correta para a reação, pode-se ter uma idéia sobre as mudanças de diferentes espécies nesse sistema. Para as reações simples, como a dissolução do NaCl na água, a equação pode ser escrita facilmente ao prever os possíveis produtos dessa reação. Mas, para outras reações complexas, podem ser realizados testes adicionais para descobrir os produtos desse sistema em particular. Mas, na maioria das vezes, é muito provável que a equação escrita seja desequilibrada, o que torna difícil explicar o comportamento químico desse sistema. Portanto, as equações desequilibradas também devem ser equilibradas. A equação equilibrada inclui todos os reagentes e produtos desse sistema. A equação é escrita considerando o composto reagente como uma molécula. Por exemplo, a equação equilibrada entre KI e PbNO 3 (se aqueles fossem reagidos em água) seria;

A importância de uma equação equilibrada é que ele revela as quantidades de reagentes que devem ser adicionadas dando detalhes sobre as relações estequiométricas entre as espécies no sistema. No exemplo acima, a relação entre PbNO 3 e KI deve ser 1: 2 ao adicionar esses componentes no sistema.
O que é uma equação iónica líquida?
A equação iónica líquida mostra apenas a reação geral que ocorreu no sistema. Inclui as espécies iónicas e os produtos formados. Mas não indica todas as reações que aconteceram em um determinado sistema. Por exemplo, se houver uma reação entre duas moléculas usando água como meio, os compostos podem ter dissolvido em água e separados em íons. Alguns desses íons podem estar envolvidos na reação, mas alguns não podem. Então, a equação iônica líquida inclui apenas os íons que participaram de uma reação líquida. Outros íons, que são chamados íons espectadores, são eliminados da equação para obter a equação iónica líquida. Por exemplo, se KI e PbNO 3 reagissem na água, a reação iónica líquida seria;
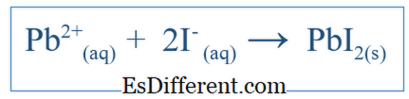
Isso também deve incluir o íon K + e o NO3 - , mas esses íons só se dissolverão e não participarão da reação principal; assim, eles não estão incluídos na reação iónica líquida.
Qual a diferença entre Equação equilibrada e Equação iónica líquida?
- diff Artigo Médio antes da Tabela ->
Equação equilibrada vs Equação iónica líquida |
|
| Todos os componentes que foram usados são escritos como os reagentes na equação equilibrada. | Os reativos que estavam apenas envolvidos na reação líquida seriam escritos na reação iónica líquida. |
| Produtos | |
| Todos os componentes no final da reação estão incluídos em uma equação equilibrada. | Em uma equação iônica líquida, apenas o produto final líquido está escrito. |
| Detalhes Dado | |
| A equação equilibrada dará detalhes sobre todas as espécies que estão no sistema. | A equação iónica líquida fornece detalhes apenas sobre espécies que participaram da reação |
Resumo - Equação equilibrada vs Equação iónica líquida
Quando certos compostos iônicos são adicionados à água, eles se separam e formam íons dissolvidos na água. Isso produz aniões e catiões. Para mostrar as espécies produzidas após a conclusão da reação e a direção da reação, uma equação química pode ser escrita. Esta equação pode ser equilibrada considerando o número de átomos de cada espécie que residem nos dois lados da flecha; Às vezes, mesmo a carga dessas espécies deve ser considerada. Isso dá uma equação química equilibrada para esse sistema particular. No entanto, a equação iónica líquida inclui apenas as espécies reagidas. Conforme mencionado anteriormente, a diferença fundamental entre equação equilibrada e equação iônica líquida é que a equação equilibrada mostra todas as reações em um sistema, enquanto que a equação iônica líquida mostra apenas a reação líquida que ocorreu na conclusão da reação particular.
Referências:
1. Chang, R., 2010. química. 10º ed. New York: McGraw-Hill.
2. Reações químicas. (n. d.). Recuperado em 26 de maio de 2017, de // www. ric. edu / faculdade / ptiskus / reactions /
3. Equações iônicas iónicas e líquidas completas. (n. d.). Recuperado em 26 de maio de 2017, em // www. khanacademy. org / ciência / química / reações químicas-estequiome / tipos de reações químicas / uma equação iónica-iónica completa e iónica.




