Diferença entre metano e etano | Metano versus Etano
Diferença-chave - Metano vs Ethane
O metano e o etano são os membros mais pequenos da família de alcanos. As fórmulas moleculares destes dois compostos orgânicos são CH 4 e C 2 H 6 , respectivamente. A diferença-chave entre metano e etano é a sua estrutura química ; uma molécula de etano pode ser considerada como dois grupos metilo unidos como um dímero de grupos metilo. As outras diferenças químicas e físicas surgem principalmente devido a essa diferença estrutural.
O que é o metano?
O metano é o membro mais pequeno da família de alcanos com a fórmula química CH 4 (quatro átomos de hidrogénio são ligados a um átomo de carbono). É considerado o principal componente do gás natural. O metano é um gás incolor, inodoro e insípido; também conhecido como carbano, gás de pântano, gás natural, tetraidrido de carbono, e carboneto de hidrogênio . Pode ser facilmente inflamado, e seu vapor é mais leve do que o ar.
O metano encontra-se naturalmente sob o solo e sob o fundo do mar. O metano atmosférico é considerado um gás com efeito de estufa. O metano divide-se em CH 3 - com água na atmosfera.
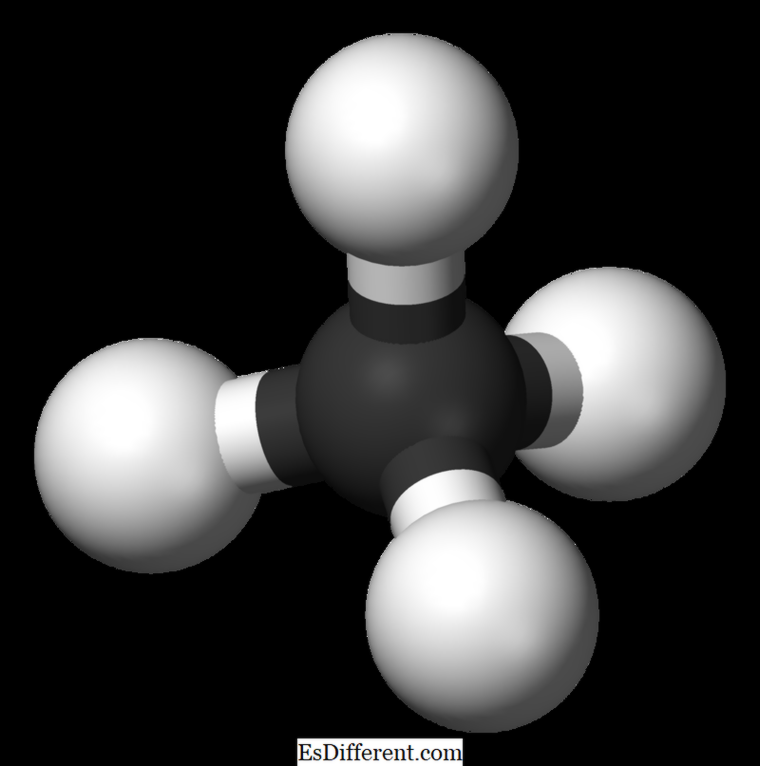
O que é Ethane?
O etano é um composto gasoso incolor e inodoro a temperatura e pressão padrão. Sua fórmula molecular e peso molecular são C 2 H 6 e 30. 07 g · mol -1 , respectivamente. É isolado de gás natural, como um subproduto do processo de refinação de petróleo. O etano é muito importante na produção de etileno.

Qual a diferença entre metano e etano?
Características do metano e do etano
Estrutura:
Metano: A fórmula molecular do metano é CH 4, e é um exemplo de uma molécula tetraédrica com quatro ligações CH equivalentes (ligações sigma). O ângulo de ligação entre os átomos de H-C-H é 109. 5 0 e todas as ligações C-H são equivalentes, e é igual a 108. 70 horas.

Etano: A fórmula molecular de etano é C 2 H 6, e é um hidrocarboneto saturado, uma vez que não contém múltiplas ligações.

Propriedades químicas:
Metano:
Estabilidade: O metano é uma molécula quimicamente muito estável que não reage com KMnO 4 , K 2 Cr < 2 O 7 , H 2 SO 4 ou HNO 3 em condições normais. Combustão:
Na presença de excesso de ar ou oxigênio, o metano queima com uma chama não luminosa azul-clara que produz dióxido de carbono e água.É uma reação altamente exotérmica; portanto, é usado como um excelente combustível. Na presença de ar ou oxigênio insuficientes, ele queima parcialmente em gás de monóxido de carbono (CO). Reacções de Substituição:
O metano mostra as reacções de substituição com halogéneos. Nessas reações, um ou mais átomos de hidrogênio são substituídos por um número igual de átomos de halogênio e é chamado de "halogenação". "Reage com cloro (Cl) e bromo (Br) na presença de luz solar. Reação com vapor:
Quando uma mistura de metano e vapor é passada através de um níquel aquecido (1000 K) suportado na superfície de alumina, ele pode produzir hidrogênio. Pirólise:
Quando o metano é aquecido a cerca de 1300 K, ele é decomposto em negro de carbono e hidrogênio. Etano:
Reações:
O gás etano (CH 3 CH 3 ) reage com o vapor de bromo na presença de luz para formar bromoetano (CH 3 CH 2 Br) e brometo de hidrogénio (HBr). É uma reação de substituição; um átomo de hidrogénio em etano é substituído por átomo de bromo. CH 3
CH 3 + Br 2 à CH 3 CH 2 Br + HBr Combustão: A combustão completa do etano produz 1559. 7 kJ / mol (51. 9 kJ / g) de calor, dióxido de carbono e água. 2 C
2 H
6 + 7 O 2 → 4 CO 2 + 6 H 2 O + 3120 kJ Também pode ocorrer sem excesso de oxigênio, produzindo uma mistura de carbono amorfo e monóxido de carbono. 2 C 2 H
6
+ 3 O 2 → 4 C + 6 H 2 O + energia 2 C 2 H 6
+ 5 O 2 → 4 CO + 6 H 2 O + energia 2 C 2 H 6
+ 4 O 2 → 2 C + 2 CO + 6 H 2 O + energia, etc. Definições: Reações de substituição: A reação de substituição é uma reação química que envolve o deslocamento de um grupo funcional em um composto químico e substituiu por outro grupo funcional.
Usos:
Metano: O metano é usado em muitos processos químicos industriais (como combustível, gás natural, gás natural liquefeito) e é transportado como um fluido refrigerado. Etano:
O etano é usado como combustível para motores e como refrigerante para um sistema de temperatura extremamente baixa. É transportado em cilindros de aço como um gás liquefeito sob sua própria pressão de vapor.
Referências: "Etano". Wikipedia
. N. p., 2016. Web. 7 de junho de 2016. Khanna, Bhishm. "Quais são as propriedades químicas do metano? ". Preservearticles. com
. N. p., 2016. Web. 7 de junho de 2016. "Metano | CH4 - Pubchem ". Pubchem. ncbi. nlm. nih. gov . N. p., 2016. Web. 7 de junho de 2016. "Metano". Wikipedia . N. p., 2016. Web. 7 de junho de 2016. Cortesia da imagem: "Modelo de molécula de metano de bola e aderência" por (Domínio Público) via Commons Wikimedia "Modelo de molécula de etano de bola e vara" e Ben Mills - Trabalho próprio (Domínio Público) via Commons Wikimedia "Metano" Por Jynto - Trabalho próprio, com base em Arquivo: Metano-CRC-MW-dimensões-2D.png (Public Domain) via Commons Wikimedia "Ethane" (Public Domain) via Commons Wikimedia

