Diferença Entre Octeto e Duplet | Octet vs Duplet
Diferença-chave - Octeto versus Duplet
Existem átomos ou compostos quimicamente ativos e inativos presentes na natureza. Essa característica é principalmente dependente do número de elétrons presentes nos reservatórios mais externos dos átomos. Os átomos com conchas incompletas podem se tornar ativos para completar sua configuração eletrônica para se tornarem estáveis. Os átomos que estão inativos têm uma configuração eletrônica completa; assim, esses átomos não reagem com nenhum outro átomo, a menos que em condições especiais. Os gases nobres são sempre inativos na natureza. Portanto, eles são conhecidos como gases inertes. Os gases inertes estão na oitava coluna na tabela periódica. Outros elementos no mesmo período (linha) tendem a obter a configuração eletrônica do gás inerte no final desse período, que é a forma mais estável na natureza. Os átomos ativos tendem a completar o número de elétrons de acordo com regra de octeto ou regra de duplet . A diferença fundamental entre o octeto e o duplet é que o octeto é um átomo ou um íon com um máximo de oito elétrons no invólucro exterior enquanto duplet é um átomo com o máximo de dois elétrons no casco mais externo.
ÍNDICE
1. Visão geral e diferença de chave
2. O que é um Octet
3. O que é um Duplet
4. Comparação lado a lado - Octet vs Duplet
5. Resumo
O que é um Octeto?
Um octeto é um átomo ou um íon possuindo oito elétrons no invólucro externo desse átomo. Todos os gases nobres, exceto o hélio, têm oito elétrons e são de natureza inerte. A configuração eletrônica de um gás nobre sempre terminará da seguinte forma.
ns 2 np 6
Por exemplo, a configuração eletrônica do Neon é 1s 2 2s 2 2p 6 . Neon é um gás inerte.
Outros elementos com elétrons de sete, seis, etc. no orbitário externo tendem a obedecer a regra de octeto obtendo elétrons de fora; alguns outros elementos que têm um, dois, etc. elétrons tendem a perder elétrons e obter a configuração de elétrons do gás inerte mais próximo. Mas outros elementos no meio da tabela periódica formarão novos vínculos com elementos com excesso de elétrons para compartilhar esses elétrons e se tornar um octeto.
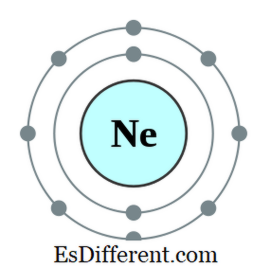
Figura 01: Neon, um octeto
O que é um Duplet?
O átomo de hidrogênio e o átomo de hélio são os elementos mais pequenos na natureza e têm apenas um orbital em torno de seu núcleo. Este orbital é chamado orbital 1s. Este orbital pode conter um máximo de dois elétrons. O átomo de hidrogênio tem um elétron e o hélio possui dois elétrons. Assim, o hélio é chamado de duplet.Helium tem o número máximo de elétrons que pode ter; portanto, é um elemento estável na natureza. Portanto, o hélio também é um gás inerte. Mas o hidrogênio tem apenas um elétron e o único orbital que possui está incompleto. Assim, o átomo de hidrogênio sozinho é muito reativo e tende a formar uma ligação covalente com outro átomo de hidrogênio compartilhando os únicos elétrons que eles possuem. Então, esses átomos de hidrogênio se tornam dupletos, pois agora eles têm dois elétrons em suas orbitais exteriores. Mas o lítio também pode se comportar como um duplet removendo o elétron do orbital externo. A configuração de elétrons do lítio é 1s 2 2s 1 . Ao remover o elétron 1 2s, ele pode se tornar um duplet. Nesse caso, He, H - e Li + são duplets que podem existir como duplets estáveis.
Todos os duplets têm configuração eletrônica que termina como segue.
ns 2

Figura 02: Helium, a duplet
Qual a diferença entre Octet e Duplet?
- diff Article Middle before Table ->
Octet vs Duplet |
|
| Octet possui oito elétrons no invólucro externo. | Duplet tem dois elétrons no casco mais externo. |
| Configuração comum de elétrons | |
| Octeto possui ns 2 np 6 configuração de elétron de tipo no final. | Duplet tem a configuração de tipo ns 2 no final. |
| Número de Orbitais | |
| Octeto pode ter um mínimo de dois orbitais. | Um duplet tem apenas um orbital. |
| Tipo de Orbitais | |
| Um octeto pode ter todos os tipos de orbitais, como s, p, d, f, etc. | Duplet tem apenas o orbital s. |
Resumo - Octeto versus Duplet
Todos os elementos tendem a se tornar estáveis. Mas com configurações de elétrons incompletas, os átomos não podem ser estáveis; assim, eles se tornam muito reativos para preencher as conchas com elétrons, ganhando, perdendo ou compartilhando elétrons. Os átomos ou moléculas que obedecem à regra de octeto ou duplet são estáveis. A principal diferença entre octeto e duplet é que o octeto tem oito elétrons em sua orbital mais externa, enquanto o duplet possui dois elétrons em sua orbital.
Referências:
1. Nema, P., 2011. Topperlearning. [Online] Disponível em: // www. até a aprendizagem. com / fóruns / home-work-help-19 / what-is-octet-duplet-valency-and-ions-chemistry-structure-of-the-atom-46317 / reply [Acessado 29 05 2017].
2. Chang, R., 2010. Química. 10º ed. Nova Iorque: McGraw-Hill.
3. Anon., 2015. Empilhador de classificação. [Online] Disponível em: // gradestack. com / NTSE-Complete-Course / Chemical-Bonding / Chemical-Activity-of-An / 19176-3853-37737-study-wtw [Acessado 29 05 2017].
Cortesia da imagem:
1. "Electron shell 002 Helium - sem rótulo" Por Pumbaa (obra original de Greg Robson) - diagramas de cadáveres eletrônicos (versão rotulada correspondente) (CC BY-SA 2. 0 uk) via Commons Wikimedia
2. "Electron shell 010 Neon" Por Pumbaa (obra original de Greg Robson) (CC BY-SA 2. 0 uk) via Commons Wikimedia



