Diferença entre a reação de combinação e de decomposição | Combinação versus Reação de Decomposição
Diferença-chave - Reação combinada vs de decomposição
Uma reação química é a conversão de um ou mais compostos químicos em um ou mais produtos diferentes, alterando a identidade de um composto químico. O material de partida de uma reação química é chamado de reagente e o composto resultante é chamado de produto. A degradação de compostos ou combinação de compostos e a formação de novos compostos ocorrerão durante um processo de reação química, uma vez que as ligações entre os átomos do composto são quebradas e criadas de maneira diferente. As reações químicas podem ser divididas em várias categorias amplas. Reações de Redox ou reações de oxidação-redução são muito importantes entre elas. As reações de oxidação e redução são chamadas reações de transferência de elétrons, uma vez que os elétrons dos reagentes são transferidos de um composto para o outro para causar a reação. Nas reações redox, duas reações paralelas, que são chamadas de semi-reações, ocorrem ao mesmo tempo. Estas meias reações mostram a transferência de elétrons. Ao equilibrar essas meias reações, pode-se adivinhar a reação global que aconteceu no final. As reações combinadas e as reações de decomposição são dois tipos principais de reações de redox. A principal diferença entre a combinação e a reação de decomposição é que a reação de combinação envolve uma combinação de reagentes para dar um único produto enquanto que a reação de decomposição envolve a quebra de um único composto em dois ou mais produtos.
ÍNDICE
1. Visão geral e diferença de chave
2. O que é uma Reação Combinativa
3. O que é uma Reação de Decomposição
4. Comparação de lado a lado - Combinação versus reação de decomposição
5. Resumo
O que é uma Reação Combinada?
Uma reação combinada, também chamada de reação de síntese , é uma reação na qual os compostos reagentes são combinados para formar um composto diferente como o produto. Em outras palavras, a reação de moléculas simples resulta em uma molécula complexa. Algumas ou todas as ligações entre átomos desse composto particular são discriminadas; Ao mesmo tempo, os átomos se combinarão para formar o novo composto, que é o produto. Nas reacções de decomposição, o mesmo reagente atua como material de partida para ambas as duas reações.Ao contrário das reações de decomposição, as meias reações em reações combinadas têm diferentes reagentes para começar. A reação combinada resulta em um único produto. O seguinte é um exemplo comum que pode ser dado como reações de combustão.
Por exemplo, quando o alumínio (Al) é colocado em brometo líquido (Br 2 ) ocorre uma reacção de combinação e produz brometo de alumínio (AlBr 3 ). Aqui, o número de oxidação é aumentado em Al e diminuiu no Br. Portanto, é uma reação redox e é uma reação de combinação desde que dois reagentes reagiram para dar um produto particular.
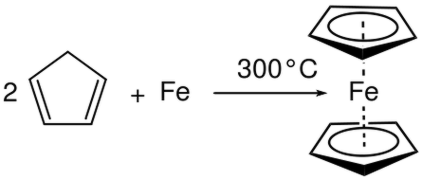
Figura 01: Reação de combinação
O que é a Reação de Decomposição?
A reação de decomposição é outra reação importante na categoria de reações redox. É basicamente o oposto da reação de combinação. Uma reação de decomposição é uma reação onde o composto reagente é dividido em produtos. Aqui, as meias reações ocorrem ao mesmo tempo que a reação de oxidação e a reação de redução. Mas, ao contrário de uma reação combinada, o reagente para ambas as meias reações é o mesmo em reações de decomposição. A reação da decomposição resulta em vários produtos.
Na eletrólise da água, quando a corrente direta é passada através da água, as moléculas de água são decompostas para dar gases de oxigênio e hidrogênio. Aqui, o número de oxidação é aumentado em átomo de oxigênio e é diminuído em átomo de hidrogênio. Por isso, é uma reação redox e uma reação de decomposição devido à degradação de moléculas de água em gases de oxigênio e hidrogênio.

Figura 02: Combinação vs decomposição
Qual a diferença entre a Reação de Combinação e Decomposição?
- diff Artigo Médio antes da Tabela ->
Combinação versus Reação de Decomposição |
|
| Dois ou mais compostos reagentes estão envolvidos em reações combinadas. | Um único composto está envolvido em uma reação de decomposição. |
| Produtos | |
| A reacção de combinação resulta num único produto. | As reações de decomposição resultam em vários produtos. |
| Half Reactions | |
| Em reações de combinação, duas meias reações possuem duas moléculas de partida diferentes. | Nas reações de decomposição, uma única molécula atua como material de partida para ambas as duas reações. |
| Chemical Bonds | |
| As reações combinadas resultam na ligação de átomos para produzir o produto final único. | Em reações de decomposição, as ligações químicas são discriminadas para formar dois ou mais produtos finais. |
| Moléculas | |
| As reações de combinação causam que as moléculas simples reagem e produza moléculas complexas. | As reações de decomposição causam que as moléculas complexas se dividam em moléculas simples. |
Resumo - Reação de Combinação versus Decomposição
As reações de Redox são muito parte do mundo que nos rodeia, porque a maioria das reações químicas importantes são reações redox. Reações combinadas e reações de decomposição são reações simples que são opostas uma da outra. A principal diferença entre a combinação e a reação de decomposição é que a reação de combinação envolve a combinação de duas ou mais moléculas reagentes para resultar em um único produto final, enquanto que a reação de decomposição envolve a quebra de uma única molécula em dois ou mais produtos.
Referências:
1. Chang, R., 2010. química. 10º ed. New York: McGraw-Hill.
2. Redox. (2009, 30 de julho). Recuperado 29 de maio de 2017, de // interações fracas. wordpress. com / primers / redox /
3. Reações. (n. d.). Consultado em 29 de maio de 2017, de // www. ric. edu / faculdade / ptiskus / reactions /
Cortesia da imagem:
1. "Miller Ferrocen Synthese" Por Bert. Kilanowski - Trabalho próprio (CC0) via Commons Wikimedia
2. "Reações químicas" Por Daniele Pugliesi - Trabalho próprio (CC BY-SA 3. 0) via Commons Wikimedia [Cropped]




