Diferença entre isotônico e hipertônico | Isotonic vs Hypertonic
Diferença-chave - Isotônico vs hipertônico
É importante entender o conceito de Tonicidade antes de analisar a diferença entre isotônico e hipertônico. Portanto, primeiro descrevemos brevemente o conceito de tonicidade e sua importância. A tonicidade é a variação na concentração de água de duas soluções divididas por uma membrana semipermeável. Também pode ser explicado como a relativa concentração de água das soluções que decidem a direção e a quantidade de difusão da água até atingir concentrações iguais em ambos os lados da membrana. Ao identificar a tonicidade das soluções, podemos determinar em que direção a água se difundirá. Esse fenômeno é comumente usado quando ilustra a resposta de células imersas em uma solução externa. Existem três classificações de tonicidade que uma solução pode ter em relação a outra. Eles são hipertônicos, hipotônicos e isotônicos. A diferença-chave entre isotônico e hipertônico é que a solução hipertônica contém mais solvente do que o soluto enquanto que o soluto e o solvente são distribuídos igualmente na solução isotônica. No entanto, memorizar a definição de soluções hipertônicas e isotônicas não é essencial se pudermos entender a diferença entre soluções isotônicas e hipertônicas.
O que é Hypertonic?Hyper é outra palavra acima ou excessiva. As soluções hipertônicas terão uma maior concentração de soluto (glicose ou sal) do que a célula. Solutos são os elementos que são dissolvidos em um solvente, formando assim uma solução. Em uma solução hipertônica, a concentração de solutos é maior fora da célula do que dentro dela. Quando uma célula é imersa em uma solução hipertônica, haverá uma mudança osmótica e as moléculas de água fluirão para fora da célula, a fim de equilibrar a concentração dos solutos e haverá encolhimento no tamanho da célula.
Iso é outra palavra para igual e tonic é para a tonicidade da solução. As soluções isotônicas terão uma concentração de soluto semelhante à da solução em que está sendo comparada. Em uma solução isotônica, a concentração de solutos é a mesma dentro e fora da célula criando um equilíbrio dentro do ambiente da organização celular. Quando uma célula está imersa em uma solução isotônica, não haverá um deslocamento osmótico e as moléculas de água difundem através da membrana celular em ambas as direções para equilibrar a concentração dos solutos.Este processo não criará inchaço ou encolhimento da célula.

As diferenças entre hipertônico e isotônico podem ser classificadas nas seguintes categorias.
Definição de
Isotonic e Hypertonic Hypertonic:
"hyper" é conhecido como acima ou excessivo + "tonic" é conhecido como algo ao longo das linhas de uma solução. Assim, hipertônico sugere maior tonicidade da solução. Isotonic:
"iso" é conhecido como o mesmo + "tonic" é conhecido como algo ao longo das linhas de uma solução. Assim, isotônico sugere tonicidade semelhante da solução. Características de
isotônica e hipertônica Concentração de soluto e solução
Solução Hypertonic:
contém mais solvente do que soluto. Isotonic:
Soluto e solvente na solução são distribuídos de forma igual. Exemplos
Hipertônico:
Água purificada, porque nenhum / pouco soluto é dissolvido na água purificada, e sua concentração é muito baixa em comparação com o ambiente celular. Isotonic:
Solução salina é um plasma isotônico para sangue humano Resposta de células em solução hipertônica e isotônica
(Ver figura 1) Hipertônico:
Quando uma célula biológica está em um ambiente hipertônico, a água flui através da membrana celular para fora da célula, a fim de equilibrar a concentração de solutos em ambas as células e o ambiente ao redor da célula. Como resultado, a célula encolherá à medida que a água sair da célula para reduzir a maior concentração de soluto no ambiente externo. Isotônico:
Quando uma célula está em uma solução isotônica, ela não criará inchaço ou encolhimento da célula. Gradiente de concentração de água
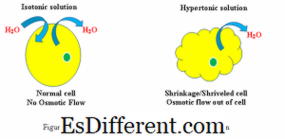
Hipertônico:
O gradiente de concentração de água pode ser observado a partir do interior da célula para a solução hipertônica Isotônico:
O gradiente de concentração de água não existe Gradiente de concentração de solução < Hypertonic:
O gradiente de concentração de solução é observado a partir da solução hipertônica para dentro da célula
Isotonic: O gradiente de concentração de solução não existe.
Mudança osmática Hypertonic:
ocorre a mudança osmótica.
Isotonic: mudança osmótica não existe
Movimento de água Hypertonic:
As moléculas de água se movem ou se difundem rapidamente do interior da célula para direções de solução externas e, portanto, a célula perderá água.
Isotônico: As moléculas de água se movem ou se difundem em ambas as direções e a taxa de difusão de água é similar em cada direção. Assim, a célula obterá ou perderá água.
Bebidas esportivas Isotônicas:
Uma bebida isotônica compreende concentrações similares de sal, carboidratos de açúcar e eletrólitos como no corpo humano. A bebida esportiva isotônica é muitas vezes preferida como uma solução de reidratação oral. Geralmente tem 4-8g de carboidrato por 100 ml.
Hypertonic: A bebida hipertônica compreende maiores concentrações de sal, carboidratos de açúcar e eletrólitos como no corpo humano.Geralmente tem aproximadamente 8 g de carboidratos por 100 ml. Uma solução hipertônica também é utilizada em osmoterapia para gerir hemorragia cerebral. Bebidas esportivas hipertônicas são ideais para aqueles que precisam de níveis muito elevados de energia.
Em conclusão, existem três formas de soluções baseadas na concentração de soluto e são isotônicas, hipotônicas e hipertônicas. A concentração de solutos é a mesma dentro e fora da célula em uma solução isotônica. A concentração de solutos é maior dentro da célula do que o ambiente externo em uma solução hipotônica, enquanto que a solução hipertônica é aquela em que a concentração de solutos é maior do ambiente externo do que dentro da célula. Referências Mansoor, M. A., Beverly, J. e Sandmann. (2002). Farmácia Física Aplicada. McGraw-Hill Professional. pp. 54-57. Voet, D., Judith, G. V. e Charlotte, W. P. (2001). Fundamentos de Bioquímica (Rev. ed.). Nova Iorque: Wiley. p. 30. Cortesia da imagem: "Pressão osmótica no diagrama das células sanguíneas" por LadyofHats - fiquei com base em [1], [2], [3] e [4] … (Domínio Público) via Wikimedia Commons




