Diferença entre o efeito Zeeman normal e anômalo | Normal versus efeito Zeeman anômalo
Diferença-chave - Efeito normais vs anômalos Zeeman
Em 1896, os físicos holandeses Pieter Zeeman observaram a divisão de linhas espectrais emitido por átomos de cloreto de sódio, quando foi mantido em um campo magnético forte. A forma mais simples deste fenômeno foi introduzida como efeito Zeeman normal. O efeito foi bem entendido depois com a introdução da teoria do elétron desenvolvida por H. A. Lorentz. O efeito anormal de Zeeman foi descoberto depois disso com a descoberta da rotação do elétron em 1925. A divisão da linha espectral emitida por átomos colocados em um campo magnético é geralmente chamada de efeito Zeeman. No efeito Zeeman normal, a linha é dividida em três linhas, enquanto que no efeito anormal de Zeeman, a divisão é mais complexa. Esta é a principal diferença entre o efeito Zeeman normal e anômalo.
ÍNDICE
1. Visão geral e diferença de chave
2. O que é efeito normal Zeeman
3. O que é Anomalous Zeeman Effect
4. Comparação lado a lado - efeito normal vs anômalo Zeeman na forma tabular
5. Resumo
O que é o efeito normal Zeeman?
O efeito Zeeman normal é o fenômeno que explica a divisão de uma linha espectral em três componentes em um campo magnético quando observado em uma direção perpendicular ao campo magnético aplicado. Este efeito é explicado pela base da física clássica. No efeito Zeeman normal, apenas o momento angular orbital é considerado. O momento angular de rotação, neste caso, é zero. O efeito Zeeman normal só é válido para transições entre os estados de singuleto em átomos. Os elementos que dão o efeito Zeeman normal incluem He, Zn, Cd, Hg, etc.
O que é o efeito Anomalous Zeeman?
O efeito Zeeman anômalo é o fenômeno que explica a divisão de uma linha espectral em quatro ou mais componentes em um campo magnético quando visto em uma direção perpendicular ao campo magnético. Este efeito é mais complexo ao contrário do efeito Zeeman normal; assim, pode ser explicado com base na mecânica quântica. Os átomos com impulso angular de rotação mostram o efeito anormal de Zeeman. Na, Cr, etc., são fontes elementais que mostram esse efeito.
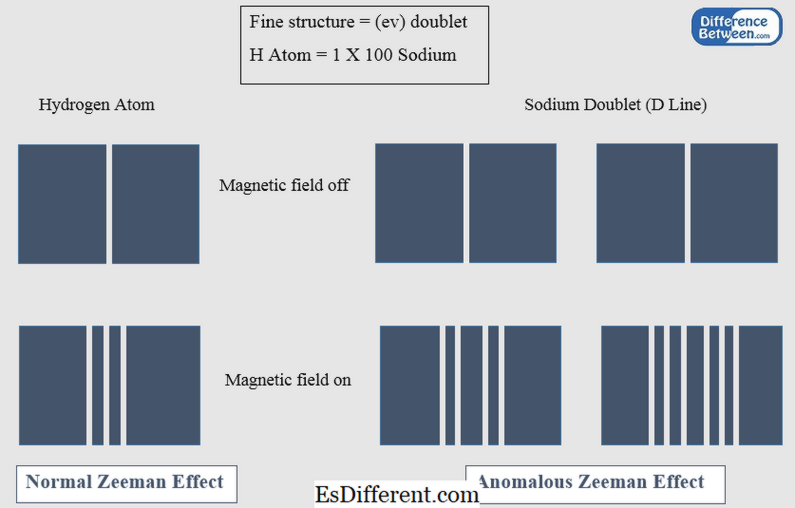
Figura 01: Efeito Zeeman normal e anômalo
Qual a diferença entre o efeito Zeeman normal e anômalo?
- diff Artigo Médio antes da Tabela ->
Efeito Normal vs Anomalous Zeeman |
|
| A divisão de uma linha espectral de um átomo em três linhas em um campo magnético é chamado efeito Zeeman normal. | A divisão de uma linha espectral de um átomo em quatro ou mais linhas em um campo magnético é chamado efeito Zeeman anômalo. |
| Basis | |
| Isto é explicado pela base da física clássica. | Isto é entendido com base na mecânica quântica. |
| Magnetic Momentum | |
| O momento magnético é devido ao momento angular orbital. | O momento magnético é devido ao impulso angular de rotação orbital e não-zero |
| Elementos | |
| O cálcio, o cobre, o zinco e o cádmio são alguns elementos que mostram esse efeito. | O sódio e o cromo são dois elementos que mostram esse efeito. |
Resumo - Efeito normal vs Anomalous Zeeman
O efeito Zeeman normal e o efeito Zeeman anômalo são dois fenômenos que explicam por que as linhas espectrales de átomos estão divididas em um campo magnético. O efeito Zeeman foi introduzido pela primeira vez por Pieter Zeeman em 1896. O efeito normal de Zeeman é devido ao único momento angular orbital que separa a linha espectral em três linhas. O efeito Zeeman anômalo é devido a um impulso angular de rotação diferente de zero, criando quatro ou mais divisões de linhas espectrales. Assim, pode-se concluir que o efeito Zeeman anômalo é realmente um efeito Zeeman normal com a adição de impulso singular de rotação, além do momento angular orbital. Assim, há apenas uma ligeira diferença entre o efeito Zeeman normal e anômalo.
Baixe a versão PDF do efeito Normal vs Anomalous Zeeman
Você pode baixar a versão em PDF deste artigo e usá-lo para fins off-line, conforme nota de citação. Baixe a versão em PDF aqui Diferença entre o efeito Zeeman normal e anômalo.
Referências:
1. Aruldhas, G. Estrutura molecular e espectroscopia. Nova Deli: PHI Learning, 2007. Imprimir.
2. Bongaarts, Peter. Teoria quântica: uma abordagem matemática. Cham: Springer, 2014. Imprimir.
3. Lipkowitz, Kenny B. e Donald B. Boyd. Comentários em química computacional. Nova Iorque: Wiley-VCH, 2000. Imprimir.



