Diferença entre Pressão Parcial e Pressão de Vapor Diferença Entre
A pressão parcial e a pressão de vapor são comumente usadas termos científicos relacionados à quantidade de pressão exercida pelos componentes do sistema, mas sua identidade pode ser confusa para outros. Existe uma clara distinção entre esses termos, incluindo seus efeitos e identidade. Este artigo irá elaborar mais sobre as diferenças entre esses termos. Também incluirá alguns exemplos para desmistificar as suas aplicações.
Comecemos por destacar o conceito de pressão antes de podermos aprofundar a distinção entre vapor e pressão parcial. A pressão é cientificamente definida como a força aplicada por unidade de área em um objeto ou uma substância. Também pode ser definido como a força aplicada pelas partículas colidindo umas nas outras e geralmente é medida usando Pascal. No caso de colisão de partículas, a equação do gás e a teoria cinética dos gases são usadas para calcular a pressão.
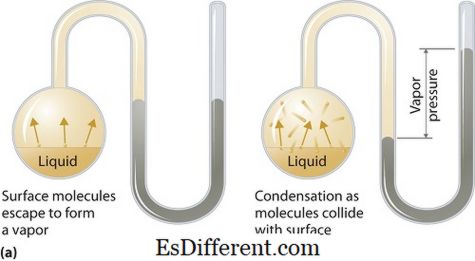
O que é a pressão de vapor?
A pressão de vapor pode aplicar-se a fases líquidas ou sólidas. É a pressão exercida pelo vapor em seu equilíbrio termodinâmico em seu estado líquido ou sólido a uma temperatura dada em um sistema fechado quando tanto o vapor quanto o líquido (sólido) estão em contato. Esta pressão surge como resultado da vaporização, que é ativada por um aumento do calor no sólido ou no líquido. Assim, a temperatura é utilizada como medida de vaporização e é diretamente proporcional à pressão de vapor. Isto significa que, quanto maior a temperatura, maior a pressão de vapor.
Durante a vaporização, as moléculas de ar escapam como resultado da maior energia cinética do ar em um sistema fechado. Então, quando em equilíbrio, surge a pressão de vapor entre o vapor e sua forma condensada de líquido (sólido). Em soluções onde as forças intermoleculares são mais fracas, a pressão de vapor tende a ser mais e, inversamente, em soluções onde as forças intermoleculares são mais fortes, a pressão de vapor é menor.
A pressão de vapor também pode ocorrer em misturas ideais como explicado pela Lei Raoult. Ele afirma que a pressão de vapor parcial de um componente particular em uma mistura líquida ou sólida é igual à pressão de vapor desse componente multiplicada pela sua fração mole naquela mistura a uma dada temperatura. O exemplo abaixo irá ilustrar isso.
Exemplo 1.
Dada uma mistura ideal de 0,5 mol. etanol e 1. 5 mol. O metanol com a pressão de vapor de 30KPa e 52KPa, respectivamente, determina a pressão de vapor parcial de cada componente.
Solução:
O número total de moles é 1. 5mol + 0. 5mol = 2. 0mol. De acordo com a Lei de Raoult, a pressão de vapor parcial é igual à pressão de vapor multiplicada pela fração molar desse componente particular.Nesse caso, o P metanol = 1. 5/2 * 52 = 39KPa e P etanol = 0. 5/2 * 30 = 7. 5KPa.
Quando você tem as pressões de vapor parciais dos componentes na mistura, você pode obter a pressão de vapor total, adicionando-os juntos. A este respeito, 7. 5 + 39 dá 46. 5KPa pressão de vapor total da mistura de soluções de etanol e metanol.
Fatores que afetam a pressão de vapor
Identidade das moléculas
Como já mencionado acima, os tipos de forças moleculares determinam a quantidade de pressão de vapor a ser exercida. Se as forças são mais fortes, então, menos pressão de vapor emerge, e se mais fraco, então surge mais pressão de vapor. Portanto, a composição do líquido ou sólido afetará a pressão de vapor.
Temperatura
Temperatura mais alta leva a uma maior pressão de vapor porque ativa mais energia cinética para quebrar as forças moleculares para que as moléculas possam escapar rapidamente da superfície líquida. Quando a pressão de vapor (pressão de vapor saturada) é igual à pressão externa (pressão atmosférica), o líquido começará a ferver. Uma temperatura mais baixa resultará com baixa pressão de vapor e levará tempo para que o líquido ferva.

Lei de Dalton de Pressões Parciais
O que é pressão parcial?
A idéia de pressão parcial foi proposta pela primeira vez pelo renomado cientista John Dalton. Ele deu origem à sua Lei de Pressões Parciais, que afirma que a pressão total exercida por uma mistura ideal de gases é igual à soma das pressões parciais de gases individuais. Diga que um recipiente particular é preenchido com gases de hidrogênio, nitrogênio e oxigênio, a pressão total, P TOTAL, será igual à soma de oxigênio, nitrogênio e hidrogênio. A pressão parcial de qualquer gás naquela mistura é calculada multiplicando a pressão total pela fração molar do gás individual.
Em poucas palavras, a pressão parcial é a pressão exercida por um gás particular na mistura como se estivesse agindo sozinho no sistema. Assim, você ignora outros gases ao determinar a pressão parcial de um gás individual. Esta teoria pode ser verificada por meio da injeção, digamos, de 0. 6atm de O 2 em um recipiente de 10. 0 L em um 230K e, em seguida, injetar 0. 4atm N 2 em um recipiente idêntico do mesmo tamanho à mesma temperatura e, em seguida, combinam os gases para medir a pressão total; Será a soma dos dois gases. Isso explica claramente a pressão parcial de um gás individual em uma mistura de gases não reativos.
Cálculo da pressão parcial
Para calcular a pressão parcial é uma brisa absoluta, uma vez que a lei de Dalton [1] fornece provisões para isso. Dependerá da informação típica fornecida. Se, por exemplo, a pressão total for dada para uma mistura de gás A e B, bem como a pressão do gás A, a pressão parcial de B pode ser calculada usando P TOTAL = P A + P B . O resto são manipulações algébricas. Mas, no caso em que apenas a pressão total da mistura foi administrada, você pode usar a fração molar do gás B para determinar a pressão parcial.A fração molar, indicada por X, pode ser encontrada dividindo os moles de gás B pelo total de moles da mistura de gás. Então, para encontrar a pressão parcial, você irá multiplicar a fração molar, X, pela pressão total. O exemplo a seguir elabora isso.
Exemplo 2.
Uma mistura de azoto e oxigénio, com 2,5 moles e 1,85 moles, respectivamente, é injectada num recipiente de 20. 0L com uma pressão total de 4atm; Calcule a pressão parcial exercida pelo gás oxigênio.
Solução:
O número total de moles na mistura é de 2. 5 + 1. 85 = 4. 35 moles. Assim, a fração molar de oxigênio, X o , será de 1. 85 moles / 4. 35 moles = 0,425 moles. A pressão parcial do oxigênio será de 0. 425 * 4atm = 1. 7atm. A pressão parcial do gás restante pode ser calculada seguindo a mesma abordagem ou pode ser calculada usando o gás oxigênio e a pressão total conforme elaborado pela lei Dalton de Pressões Parciais que a pressão total de gases não reativos é igual à soma de as pressões parciais.
Diferença entre vapor e pressão parcial
Das explicações acima, é evidente que a pressão de vapor e a pressão parcial são duas pressões distintas. A pressão de vapor aplica-se a fases líquidas e sólidas enquanto a pressão parcial se aplica na fase gasosa. A pressão de vapor é exercida na transição de fase após o calor suficiente ter sido adicionado à solução, levando as suas moléculas a escaparem em um sistema fechado.
A principal diferença entre pressão parcial e pressão de vapor é que a pressão parcial é a pressão exercida por um gás individual em uma mistura como se estivesse sozinha nesse sistema, enquanto a pressão de vapor se refere à pressão exercida pelo vapor em sua equilíbrio termodinâmico com seu estado condensado de líquido ou sólido. A tabela abaixo fornece uma comparação concisa dessas pressões.
| Pressão de vapor | Pressão parcial |
| É exercida por vapor líquido ou sólido em sua fase condensada em equilíbrio | É exercida por gases individuais em uma mistura de gases não reativa |
| Bem explicado por Raoult Lei | Bem explicada pela Lei de Dalton |
| Aplicável em fases sólidas e líquidas | Aplicável em fases gasosas apenas |
| Independente da área de superfície ou do volume do sistema | Calculado com os gases no mesmo volume |
| Calculado usando a fração molar do soluto | Calculado usando a fração mole do gás |
Enrolar!
A pressão de vapor e a pressão parcial são dois termos científicos importantes utilizados na determinação dos efeitos das forças aplicadas pelo vapor e os gases, respectivamente, em determinado sistema fechado a temperaturas específicas. Sua principal diferença é a área de aplicação com a pressão de vapor aplicada em fases líquidas ou sólidas, enquanto a pressão parcial é aplicada em um gás individual em uma mistura de gases ideais em um determinado volume.
A pressão parcial é calculada facilmente seguindo a Lei de Pressões Parciais de Dalton, enquanto a pressão de vapor é calculada aplicando a Lei Raoult.Em qualquer mistura dada, cada componente de gás exerce sua própria pressão, que é chamada de pressão parcial independente de outros gases. E quando você dobra os moles de qualquer componente com a temperatura constante, você aumentará sua pressão parcial. De acordo com a relação Clausius-Clapeyron [2], a pressão de vapor aumenta à medida que a temperatura aumenta.
Com as informações acima mencionadas, você deve distinguir entre pressão de vapor e pressão parcial. Você também deve ser capaz de calculá-los usando as frações molares e multiplicando pela pressão total. Nós lhe demos exemplos típicos para elaborar sobre a aplicação dessas pressões.




