Diferença entre isômeros geométricos e isômeros estruturais
Isômeros geométricos versus isômeros estruturais
Os isômeros são compostos diferentes com a mesma fórmula molecular. Existem vários tipos de isômeros. Os isômeros podem ser divididos principalmente em dois grupos como isómeros e estereoisómeros constitucionais. Os isômeros constitucionais são isómeros em que a conectividade dos átomos difere em moléculas. Nos estereoisómeros, os átomos estão conectados na mesma sequência, ao contrário dos isómeros constitucionais. Os estereoisómeros diferem apenas no arranjo de seus átomos no espaço. Os estereoisómeros podem ser de dois tipos, enantiômeros e diastereómeros. Os diastereómeros são estereoisómeros, cujas moléculas não são imagens espelhadas umas das outras. Os enantiômeros são estereoisómeros, cujas moléculas são imagens espelhadas não superponíveis umas das outras. Os enantiômeros ocorrem apenas com moléculas quirais. Uma molécula quiral é definida como uma que não é idêntica à sua imagem espelhada. Portanto, a molécula quiral e sua imagem espelhada são enantiómeros um do outro. Por exemplo, a molécula de 2 butanol é quiral, e ela e suas imagens de espelho são enantiômeros.
Isômeros geométricos
Os isómeros geométricos são um tipo de estereoisómeros. Este tipo de isômeros resulta, quando as moléculas têm uma rotação restrita, basicamente, devido a uma ligação dupla. Quando existe uma única ligação carbono-carbono, a rotação é possível. Portanto, no entanto, nós desenhamos os átomos, seu arranjo será o mesmo. Mas quando existe uma ligação dupla carbono-carbono, podemos desenhar dois arranjos de átomos em uma molécula. Os isómeros resultantes são conhecidos como isómeros cis, trans ou isómeros E-Z. Em isómero cis, os mesmos tipos de átomos estão no mesmo lado da molécula. Mas, no isómero trans, os mesmos tipos de átomos estão no lado oposto da molécula. Por exemplo, as estruturas cis e trans para 1, 2-dicloroetano são as seguintes.
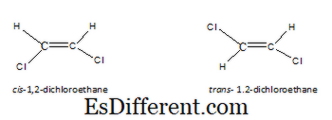
Para que uma molécula tenha isómeros geométricos, não basta apenas ter uma ligação dupla. Os dois átomos ou grupos ligados a uma extremidade da dupla ligação devem ser diferentes. Por exemplo, a molécula seguinte não possui isómeros geométricos, ambos os átomos na extremidade esquerda são os hidrogênios. Por isso, se desenhamos isso em cis ou trans, ambas as moléculas são as mesmas.

Mas não importa se os quatro grupos ou átomos anexados são diferentes. Nessa ocasião, podemos nomeá-los como E ou Z.
Isômeros Estruturais
Estes também são conhecidos como isômeros constitucionais. Os isômeros constitucionais são isômeros, onde a conectividade dos átomos difere nas moléculas. O butano é o alcano mais simples para mostrar o isomerismo constitucional. O butano possui dois isômeros constitucionais, o próprio butano e o isobuteno.

Uma vez que suas conectividades são diferentes, duas moléculas possuem diferentes propriedades físicas e químicas.Os isômeros estruturais podem ser formados por hidrocarbonetos, onde possuem pelo menos quatro átomos de carbono. Existem três tipos de isómeros estruturais como isómeros esqueléticos, posicionais e funcionais. No isomerismo esquelético, como indicado no exemplo acima, o esqueleto é rearranjado para dar diferentes isômeros. Nos isómeros de posição, um grupo funcional ou outro grupo muda de posição. Nos isómeros de grupos funcionais, embora tenham a mesma fórmula, as moléculas diferem para ter grupos funcionais diferentes.
|
Qual a diferença entre Isómeros geométricos e isómeros estruturais ? • Os isómeros geométricos são estereoisómeros. Portanto, há conexões também são semelhantes em relação aos isômeros estruturais, onde os isômeros diferem devido às conectividade dos átomos. Em isómeros geométricos, eles diferem devido ao arranjo tridimensional no espaço. • Muitas vezes, para uma molécula, existem dois isómeros geométricos como cis, trans ou E, Z, mas para uma molécula pode haver um grande número de isómeros estruturais. • O isomerismo geométrico é basicamente mostrado por moléculas com duplas duplas carbono-carbono. O isomerismo estrutural também é mostrado por alcanos, alcenos, alquinos e compostos aromáticos. |




