Diferença entre Sigma e Pi bond Diferença entre
O que é Sigma bond?
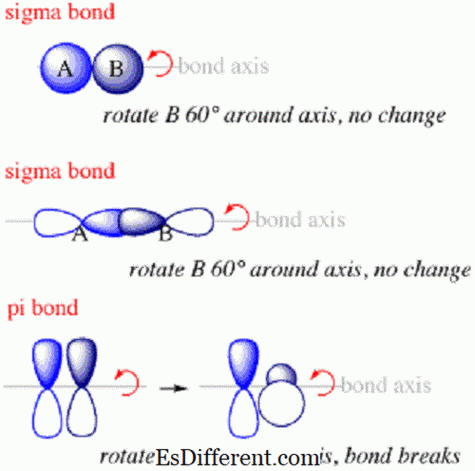
As ligações Sigma são ligações entre átomos dentro de moléculas formadas ao longo do eixo que liga os núcleos ligados dos átomos.
Ligações moleculares
As moléculas se formam quando os átomos trocam ou compartilham elétrons através de ligação química. Existem essencialmente três tipos de títulos. Ligações iónicas, ligações metálicas e ligações covalentes. Em ligações iônicas, os átomos simplesmente trocarão um elétron para que um átomo se torne carregado positivamente e o outro carregado negativamente, fazendo com que eles se atraem pela força eletromagnética. Em ligações metálicas, os elétrons serão uniformemente distribuídos através de toda a molécula criando um mar de elétrons livres e deslocalizados envolvendo íons carregados positivamente atraídos para os elétrons.
Dentro dos laços covalentes, os elétrons são compartilhados e a maneira como eles são compartilhados é através das nuvens de probabilidade dos elétrons e dos orbitais nos quais eles estão localizados, sobrepostos de maneira bastante simétrica.
Orbitais e ligações sigma
Os orbitais são regiões em torno de átomos associados a determinados níveis de energia. Os elétrons em orbitais mais distantes do núcleo terão mais energia do que elétrons em orbitais mais próximos do núcleo. Quando os orbitais de um átomo se sobrepõem com os orbitais de outro átomo, eles formam orbitais moleculares que permitem ligações moleculares que, é claro, permitem moléculas.
As ligações de Sigma são o primeiro tipo de ligação que se formará entre os átomos. Dentro de uma ligação sigma, as nuvens de probabilidade de elétrons estarão ao longo do eixo que liga os núcleos dos átomos colados. As ligações Sigma normalmente formarão quando s orbitais de átomos diferentes se sobrepõem para criar uma ligação. Eles sempre se formarão ao longo do eixo entre os dois núcleos porque o orbital s está disposto em algo como uma esfera ao redor do núcleo.
Ligações sigma e orbitais sigma
Os elétrons que compõem a ligação sigma estarão dentro dos orbitais sigma e, portanto, estarão em algum lugar ao longo do eixo que liga os núcleos dos átomos colados. A ligação sigma pode, no entanto, ser estável ou instável dependendo se os elétrons estão em um orbital de ligação sigma ou um orbital anti-ligação.
Os orbitais de ligação Sigma estarão no espaço entre os núcleos, enquanto que os orbitais anti-ligação serão ao longo do eixo que liga os núcleos, mas nos lados dos átomos opostos ao espaço entre eles. A ligação sigma será estável se mais elétrons estiverem nos orbitais de ligação e instáveis se houver mais nos orbitais anti-contaminantes ou se houver um número igual de elétrons em ambos.
O que é Pi bond?
As ligações Pi são ligações entre átomos dentro de moléculas onde os elétrons estão acima e abaixo do eixo que conectam os núcleos dos átomos unidos, mas não ao longo do eixo.Eles são o segundo tipo de ligação que se formará dentro de uma molécula após a ligação sigma.
Pi ligações e p orbitais
A razão pela qual as ligações pi se formam acima e abaixo do eixo de ligação, mas não ao longo dele é porque eles geralmente se formam de orbitais sobrepostos, como p orbitais nos átomos ligados. Esses orbitais não têm uma densidade eletrônica no núcleo. Como resultado, os elétrons que compõem os enlaces pi que se formam a partir dos orbitais sobrepostos p sempre se agruparão em uma região que não está diretamente adjacente ao núcleo. Pi ligações também podem se formar entre outros orbitais atômicos, como d orbitais que possuem características em comum com p orbitais.
Ligações Pi e orbitais pi
Quando p orbitais de átomos diferentes se sobrepõem, eles criam orbitais moleculares de pi que permitem a formação de ligações pi. A ligação pode novamente ser estável ou instável dependendo do orbital no qual o elétron está localizado. O vínculo pi será estável se mais elétrons estiverem nos orbitais de ligação do pi. Será instável se houver mais nos orbitais anti-ligação ou se um número igual estiver em ambos.
As semelhanças entre ligações sigma e ligações pi
As ligações Sigma e as ligações pi são ambas baseadas em orbitais moleculares específicos que são derivados da sobreposição de orbitais atômicos particulares, por exemplo, s orbitais no caso de sigma bond e p orbitais no caso de ligações pi. Eles também podem ser estáveis ou instáveis dependendo de se os elétrons estão nos orbitais moleculares de ligação ou orbitais moleculares anti-ligação.
Diferenças entre ligações sigma e ligações pi
Apesar de suas semelhanças, existem diferenças importantes.
- Os elétrons que compõem as ligações sigma serão distribuídos no espaço ao longo do eixo que liga os núcleos unidos, enquanto os elétrons dentro das ligações pi serão distribuídos acima e abaixo do eixo, mas não ao longo dele.
- As ligações de Sigma são as primeiras ligações a formar entre os átomos dentro das moléculas, enquanto as ligações de pi são as segundas.
- As ligações Sigma são muitas vezes formadas pela combinação de orbitais s em átomos diferentes, enquanto as ligações de pi são formadas a partir da combinação de p e orbitais semelhantes em diferentes átomos.
- Além disso, a orientação dos orbitais sobrepostos que formam ligações pi será perpendicular à dos orbitais sobrepostos que formam ligações sigma.
Ligações Sigma vs. ligações pi
| Ligações Sigma | Ligação Pi |
| Os orbitais atômicos se sobrepõem ao longo do eixo de ligação | Os orbitais atômicos se sobrepõem acima e abaixo do eixo de ligação |
| Primeiras ligações para formarem átomos dentro das moléculas | Segundo vínculos para formar entre átomos dentro de moléculas |
| Formado a partir de orbitais sobrepostos, como s orbitais | Formados a partir de orbitais sobrepostos, como p orbitais |
| Orbitais sobrepostos perpendiculares às das ligações pi | Órbitas sobrepostas perpendiculares às das ligações sigma |
Resumo: Ligações Sigma e Pi
A ligação sigma é um vínculo entre os átomos dentro de uma molécula que é geralmente formada por s < orbitais sobrepostos ao longo do eixo que liga os núcleos unidos.É o primeiro a se formar e a sua estabilidade depende da forma como os elétrons são distribuídos nos orbitais de ligação sigma e de antienvolvimento. As ligações de Pi são ligações moleculares formadas muitas vezes por sobreposição de orbitais p de átomos diferentes. Os elétrons que compõem as ligações pi serão distribuídos acima e abaixo do eixo que conectam os núcleos dos átomos colados, mas não ao longo do eixo. A estabilidade desses vínculos também depende dos orbitais de pi de ligação e anti-ataque. Sigma ligações serão os primeiros laços para formar dentro de moléculas, enquanto pi ligações serão as segundas ligações para formar. Os laços Pi também se formam a partir de orbitais atômicos que são orientados perpendicularmente aos que compõem as ligações sigma.



